Festuca myuros
Explore More :
Explore plus :
Overview
Aperçu
Regulation :
Remarques Réglementation:
Regulation Notes:
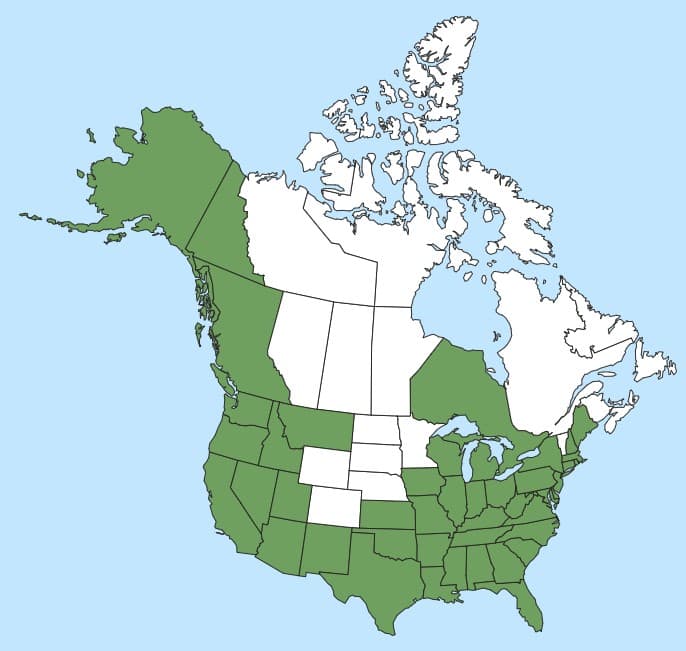
Distribution :
Répartition :
Le Festuca myuros est une graminée annuelle qui serait indigène de presque la totalité de l’Europe de l’Ouest, du bassin méditéranéen, l’Afrique septentrionale, de l’Asie occidentale et centrale et du sous-continent indien (USDA-ARS 2023).
Le Festuca myuros a été largement introduit et s’est naturalisé en Afrique australe, en Europe de l’Est et du Nord, en Australasie, en Chine, à Taïwan, au Japon, en Amérique du Nord, en Amérique du Sud, en Amérique centrale, dans les Caraïbes et dans les îles subantarctiques (Büchi et al., 2020; USDA-ARS, 2023; GOERT, s.d.). Il est considéré comme une graminée envahissante problématique dans les régions du sud et de l’est du Cap en Afrique du Sud, et dans les régions tempérées de l’Australasie (Büchi et al., 2020). En Amérique du Nord, le F. myuros est naturalisé dans l’ensemble de la zone continentale des États-Unis, à l’exclusion de la région centrale, et en colombie-Britannique, en Ontario et au Yukon au Canada (Barkworth et al., 2007; USDA-ARS, 2023).
Habitat and Crop Association :
Habitat et Cultures Associées :
Le Festuca myuros pousse habituellement dans des milieux rudéraux secs, sur des berges de sable ou de gravier, en bordure de routes et de remblais, dans des prairies, des marais salés, des forêts clairsemées, des prés, des dunes côtières, des zones riveraines, des chaparrals, des pâturages, des milieux perturbés et des terrains vagues, généralement dans des sols acides (DiTomaso et Healy, 2007; Weber, 2017; Büchi et al., 2020; CABI, 2023; GOERT, s.d.).
Le Festuca myuros est une mauvaise herbe des pâturages, des productions de semences de graminées et des systèmes de culture sans travail du sol, à travail du sol réduit ou avec semis direct, comme ceux utilisés pour le Brassica napus (colza oléagineux) et les céréales d’hiver, particulièrement le Triticum aestivum subsp. aestivum (blé d’hiver) (Alderman et al., 2011; Lyon et al., 2018; Akhter et al., 2020; Büchi et al., 2020; CABI, 2023).
Le F. myuros est une plante à croissance rapide qui peut supplanter les graminées vivaces indigènes à croissance lente et dominer des zones entières (CABI, 2023; GOERT, s.d.). L’Elymus glaucus (élyme glauque), l’Hordeum brachyantherum (orge des prés), le Koeleria macrantha (koelérie à crêtes), le Melica californica et le Nassella pulchra font partie des graminées indigènes menacées par le F. myuros dans l’Ouest des États-Unis (CABI, 2023).
Economic Use, cultivation area, and Weed Association :
Utilisation économique, zone de culture et association de mauvaises herbes :
Aux États-Unis, la variété ‘Zorro’ du F. myuros est vendue sur le marché (Alderson et Sharp, 1995). Cette graminée annuelle agressive dont la maturation est hâtive et l’établissement est supérieur est intentionellement semée pour la végétalisation des milieux perturbés et des zones endommagées par les feux de forêt, la remise en état des sites miniers et la lutte contre l’érosion control ainsi que comme culture de couverture dans les vignobles et les vergers (Alderson et Sharp, 1995; DiTomaso et Healy, 2007; Weber, 2017; Büchi et al., 2020). Au Japon et en Chineil est utilisé comme culture de couverture dans les vignobles et les vergers (Büchi et al., 2020).
Duration of Life Cycle :
Durée du cycle vital:
Annuel
Dispersal Unit Type :
Type d’unité de dispersion :
Fleuron
General Information
RENSEIGNEMENTS GÉNÉRAUX
Le Festuca myuros se comporte généralement comme une mauvaise herbe annuelle d’hiver, mais il n’est pas rare que ses graines germent au printemps (Akhter et al., 2020). Les graines de l’espèce ont une courte période de dormance et peuvent survivre aux hivers rigoureux, ce qui contribue à son comportement de mauvaise herbe dans les culture d’hiver (Akhter et al., 2020; Büchi et al., 2020). Les composés allélopathiques produits par les plantes vivantes du F. myuros produisent ainsi que les résidus toxiques associés aux plantes en décomposition nuisent à la germination et à la croissance des plantes cultivées et des plantes indigènes (CABI, 2023).
Les graines du F. myuros survivent généralement un an lorsqu’elles demeurent à la surface du sol, et peuvent survivre deux ou trois ans lorsqu’elles sont enfouies (DiTomaso et Healy, 2007; Lyon et al., 2018; Akhter et al., 2020; GOERT s.d.). Les graines sont principalement dispersées par les animaux, les vêtements et l’équipement auxquels elles s’accrochent (Weber, 2017; Akhter et al., 2020; GOERT, s.d.).
Le Festuca myuros représente une graminée fourragère de faible qualité pour le bétail, et les fleurons matures sont très pointus et peuvent blesser la gueule, les narines et les yeux de ces animaux (DiTomaso et Healy, 2007).
Remarque : Certains auteurs distinguent les genres Vulpia et Festuca, le premier groupe présentant généralement un cycle vital annuel et des fleurs monostaminées ayant tendance à s’autoféconder (cléistogamie); les plantes du genre Festuca sont quant à elles généralement vivaces, tristaminées et chasmogames (pollinisation libre). De plus, certains auteurs ont intégré au genre Festuca les espèces traditionnellement classées dans le genre Vulpia, et cette classification est celle actuellement retenue dans la base de données du GRIN et dans les règles de l’AOSA (AOSA, 2022; USDA-ARS, 2023).
Identification
Identification
-
Épillet
Dimensions
- Longueur de l’épillet : 5 – 13 mm (sans les arêtes) (Tutin et al., 1980; Sharp et Simon, 2002; Barkworth et al., 2007; Baldwin et al., 2012).
Dimensions de l’épillet selon d’autres sources :
• Longueur de l’épillet : 6 – 10,5 mm (sans les arêtes); composition de l’épillet : 2-5 fleurons fertiles et 1-2 fleurons distaux stériles ou mâles (Tutin et al., 1980).
• Longueur de l’épillet : 7 – 13 mm; composition de l’épillet : 3 – 10 fleurons (Sharp et Simon, 2002).
• Longueur de l’épillet : 5 – 12 mm; composition de l’épillet : 3 – 7 fleurons (Barkworth et al., 2007).
• Longueur de l’épillet : 5 – 11,5 mm (Baldwin et al., 2012).Forme
- Épillet oblong, comprimé latéralement.
Texture de la surface
- Épillet à surface mince et papyracée, présentant parfois des poils courts ou des poils longs.
Couleur
- Épillet brun jaunâtre pâle.
Autres caractéristiques
Composition de l’épillet
- Épillet composé de 3 – 10 fleurons semblables; semblables; fleurons distaux généralement réduits et staminés ou stériles (Tutin et al., 1980; Sharp et Simon, 2002).
Glumes
- Glume inférieure longue de 0,4 – 2,5 mm, mesurant le dixième aux deux cinquièmes de la longueur de la glume supérieure; longueur de la glume supérieure 2,5 – 6,5 mm (y compris l’arête mesurant jusqu’à 1 mm de longueur) (Tutin et al., 1980).
Désarticulation de l’épillet
- Épillet se désarticulant généralement au-dessus des glumes et entre les fleurons au niveau des nœuds de la baguette.

Festuca myuros (rattail fescue) glumes and attached pedicel; in this species the lower glume is less than one-half the length of the upper glume. [Vulpia myuros] Scale in mm

-
Fleuron
Dimensions
- Longueur du fleuron* : 5,5 – 6,9 mm (moyenne 6,4 mm); largeur* : 0,4 – 0,7 mm (moyenne 0,5 mm)
- Longueur de l’arête* : 5,0 – 13,1 mm (moyenne 10,6 mm)
- Longueur de la baguette* : 0,8 – 1,0 mm (moyenne 0,9 mm)
*Remarque : mesures minimale et maximale établies à partir d’images de 20 fleurons entrant dans la plage normale de valeurs chez cette espèce, choisis aléatoirement (ISMA, 2020). CDA-S-23329 et CDA-S-23337.
Dimensions du fleuron selon d’autres sources :
• Longueur de la lemme : 4,5 – 7,5 mm; largeur : 0,8 – 1,3 mm; arête généralement 1 – 2 fois aussi longue que la lemme (Tutin et al., 1980).
• Longueur de la lemme : 4,5 – 5 mm; largeur : environ 0,5 mm; arête généralement 1,5 – 2,5 fois aussi longue que la lemme (Bojňanský et Fargašová, 2007).
• Longueur de la lemme : 4,7 – 8,5 mm; longueur de l’arête : 5 – 19,6 mm; longueur de la baguette : 0,9 – 1,9 mm (Sharp et Simon, 2002).
• Longueur de la lemme : 4,5 – 7 mm; longueur de l’arête : 5 – 15(22) mm; longueur de la baguette : 0,75 – 1(1,9) mm (Barkworth et al., 2007).
• Longueur de la lemme : 4,5 – 6,5 mm; longueur de l’arête : 5 – 15 mm (Baldwin et al., 2012).Forme
- Fleuron linéaire à très étroitement larmiforme (très étroitement lancéolé), comprimé sur le plan dorso-ventral et enroulé.
Texture de la surface
- Lemme mince et papyracée.
- Paléole membraneuse et presque transparente.
Couleur
- Fleuron brun jaunâtre pâle, parfois teinté de violet.
Autres caractéristiques
Lemme
- Lemme effilée, se prolongeant en une longue arête droite.
- Lemme recouvrant généralement les bords de la paléole, mais laissant habituellement les carènes de la paléole exposées.
- Lemme présentant 5 nervures.
- Lemme lisse ou recouverte de courts poils raides; bords de la moitié supérieure de la lemme présentant parfois une rangée de long poils droits.
Arête
- Arête longue et droite.
- Arête recouverte de courts poils raides.
Cicatrice d’attache
- Cicatrice glabre.
- Cicatrice relativement épaisse au centre et à bords extérieurs étroits, ressemblant à une pointe légèrement arrondie.
- Cicatrice longue d’environ 0,2 mm (Tutin et al., 1980).
Baguette
- Baguette mince et cylindrique, généralement recouverte de courts poils raides.
Paléole
- Paléole légèrement plus courte que la lemme.
- Paléole presque transparente à travers laquelle le caryopse est visible; toutefois, la lemme et la paléole sont enroulées et cachent le caryopse.
- Paléole légèrement granuleuse entre les carènes.
- Carène de la paléole présentant des poils (dents de la paléole) uniformément espacés, courts et raides, larges à la base et s’effilant en une pointe; poils de longueur uniforme jusqu’au sommet de la paléole.

Festuca myuros (vulpie queue-de-rat) fleurons




-
Caryopse
Dimensions
- Longueur du caryopse* : 3,2 – 4,5 mm (moyenne 4,0 mm); largeur* : 0,5 – 0,6 mm (moyenne 0,6 mm)
- Longueur du hile* : 2,2 – 3,5 mm (moyenne 2,9 mm)
*Remarque : mesures minimale et maximale établies à partir d’images de 10 caryopses entrant dans la plage normale de valeurs chez cette espèce, choisis aléatoirement (ISMA, 2020). CDA-S-45766.
Dimensions du caryopse selon d’autres sources :
• Longueur du caryopse : 3,2 – 3,6 mm; largeur : environ 0,4 mm (Bojňanský et Fargašová, 2007).
• Longueur du caryopse : 3 – 5 mm (Barkworth et al., 2007).
• Longueur du caryopse : 3,5 – 4,5 mm (Baldwin et al., 2012).Forme
- Caryopse étroitement linéaire, pointu à l’extrémité renfermant l’embryon, droit, comprimé sur le plan dorso-ventral, parfois légèrement enroulé du côté du hile et formant une dépression longitudinale sur la paléole.
Texture de la surface
- Caryopse à surface lisse, mate à légèrement luisante; lemme et paléole parfois adhérentes.
Couleur
- Caryopse brun rougeâtre.
Autres caractéristiques
- Hile linéaire, d’une longueur correspondant environ aux trois quarts de la longueur du caryopse, situé dans une dépression longitudinale.

Festuca myuros (rattail fescue) caryopses, embryo view (left) and hilum view (right). [Vulpia myuros] Scale in mm

-
Embryon
Dimensions
- Longueur de l’embryon* : 0,4 – 0,7 mm (moyenne 0,6 mm).
- Embryon mesurant environ le septième de la longueur du caryopse.
*Remarque : mesures minimale et maximale établies à partir d’images de 10 embryons entrant dans la plage normale de valeurs chez cette espèce, choisis aléatoirement (ISMA, 2020). CDA-S-45766.
Forme
- Embryon étroitement larmiforme.
Albumen
- Albumen solide (Terrell, 1971).
Autres caractéristiques
- Embryon en position latérale (Martin, 1946).

Festuca myuros (rattail fescue) caryopses, embryo view (left) and hilum view (right). [Vulpia myuros] Scale in mm

Identification Tips
CONSEILS POUR L’IDENTIFICATION
Dans le cadre des analyses de semences, les trois espèces annuelles de Festuca les plus couramment observées sont le F. bromoides, le F. myuros et le F. octoflora. Les fleurons du F. myuros et du F. bromoides sont très semblables et sont souvent confondus.
- La glume inférieure mesure généralement moins de la moitié de la longueur de la glume supérieure chez le Festuca myuros, tandis que chez le F. bromoides elle mesure de la moitié aux trois quarts de la longueur de la glume supérieure. La longueur des glumes est le principal caractère diagnostique permettant de distinguer le F. bromoides et le F. myuros.
- Les fleurons matures du F. myuros sont généralement droits, alors que ceux du F. bromoides semblent courbés en vue laétrale.
- Les fleurons du F. myuros et du F. bromoides sont plus grands que ceux du F. octoflora.
- Les fleurons du F. myuros et du F. bromoides sont longs et étroits, tandis que ceux du F. octoflora sont étroitement larmiformes.
- Les bords de la moitié supérieure de la lemme peuvent présenter de longs poils droits chez le F. myuros, alors que les bords de la lemme ne présentent pas de tels poils chez le F. bromoides.
Les caractéristiques diagnostiques de ces trois espèces sont présentées dans le tableau de comparaison de la section Espèces semblables de la présente fiche.

Festuca myuros (vulpie queue-de-rat) fleurons






Additional Botany Information
AUTRES RENSEIGNEMENTS BOTANIQUES
Fleurs/Inflorescences
- L’inflorescence du Festuca myuros forme généralement une panicule ou un racème semblable à un épis, dressé ou légèrement retombant, et mesure 5 – 35 cm de long et jusqu’à 2 cm de large (Tutin et al., 1980; Barkworth et al., 2007).
- La plante se reproduit généralement par autofécondation (Barkworth et al., 2007; DiTomaso et Healy, 2007).
Caractéristiques Végétatives
- Le Festuca myuros produit des tiges isolées ou formant des touffes lâches, hautes de 10 – 75 (90) cm (Barkworth et al., 2007).
- Le système racinaire est fibreux et s’enfonce généralement peu profondément dans le sol (Lyon et al., 2018; Akhter et al., 2020).
Similar Species
ESPÈCES SEMBLABLES
L’identification des espèces semblables est fondée sur l’étude de la morphologie des graines; les espèces qui possèdent des unités de dispersion semblables sont retenues. L’étude est limitée par la disponibilité des spécimens physiques et des publications au moment de l'examen et peut être teintée par la subjectivité des auteurs, compte tenu de leurs connaissances et de leur expérience. L’information sur les espèces semblables qui est fournie pour faciliter l’identification des graines vise à faire connaître aux utilisateurs les similitudes qui pourraient mener à des erreurs d’identification.
Le Festuca myuros et le F. bromoides contaminent couramment les lots de semences. Le Festuca myuros est parfois vendu comme plante antiérosive (Alderson et Sharp, 1995). Le Festuca octoflora est lui aussi vendu comme plante antiérosive (USDA-ARS, 2023), mais les fleurons du F. octoflora sont généralement plus petits que ceux du F. myuros ou du F. bromoides, et présentent des arêtes beaucoup plus courtes. Les caractéristiques diagnostiques de ces trois espèces sont présentées dans le tableau de comparaison.
Deux autres espèces indigènes d’Amérique du Nord sont parfois trouvées dans les échantillons de semences; le Festuca microstachys, indigène de l’ouest de l’Amérique du Nord, depuis la Colombie-Britannique jusqu’à la Basse-Californie, et le Festuca sciurea, indigène du sud-est des États-Unis (Barkworth et al., 2007; USDA-NRCS, 2023). Les fleurons et les glumes du F. microstachys sont de longueur semblable à ceux du F. myuros; cependant, et dépendamment de la variété botanique, les fleurons et/ou les glumes du F. microstachys peuvent être recouverts de poils de longueurs diverses ou être glabres (Barkworth et al., 2007). Chez le Festuca sciurea, la lemme est généralement plus petite (2,5 – 3,5 mm; 3 nervures), et les poils près du sommet de la lemme sont beaucoup plus longs (Barkworth et al., 2007).
Tableau de comparaison des caractéristiques des fleurons et des glumes matures du Festuca myuros, du F. bromoides et du F. octoflora. Les mesures* indiquées ont été déterminées par l’auteure, d’après le protocole de mesure de l’ISMA (2020).
|
|
F. myuros |
F. bromoides |
F. octoflora |
|
Glumes |
Glume inférieure mesurant moins de la moitié de la longueur de la glume supérieure |
Glume inférieure mesurant au moins la moitié de la longueur de la glume supérieure |
Glume inférieure mesurant au moins la moitié de la longueur de la glume supérieure |
|
Forme du fleuron |
Linéaire |
Étroitement linéaire-larmiforme (étroitement lancéolé), comprimé sur le plan dorso‑ventral; portion centrale droite ou courbée vers l’arrière en vue latérale |
Étroitement larmiforme (lancéolé) |
|
Longueur du fleuron* |
5,5 – 6,9 mm (moyenne 6,4 mm) |
4,1 – 7,7 mm (moyenne 5,9 mm) |
2,5 – 4,7 mm (moyenne 3,7 mm) |
|
Largeur du fleuron*
|
0,4 – 0,7 mm (moyenne 0,5 mm) |
0,4 – 0,8 mm (moyenne 0,6 mm) |
0,5 – 0,8 mm (moyenne 0,6 mm) |
|
Texture et pilosité de la surface de la lemme |
En grande partie lisse à recouverte de courts poils raides, présentant parfois de longs poils sur les bords dans la partie supérieure |
En grande partie lisse dans le tiers inférieur et recouverte de courts poils raides dans le tiers ou les deux tiers supérieurs |
Dépendamment de la variété, lisse ou recouverte de courts poils raides ou de longs poils souples |
|
Longueur de l’arête de la lemme * |
5,0 – 13,1 mm (moyenne 10,6 mm) |
2,8 – 13,3 mm (moyenne 6,1 mm) |
0,6 – 2,8 mm (1,5 mm) |
|
Cicatrice d’attache |
Cicatrice lisse, glabre, relativement épaisse au centre et à bords extérieurs étroits, ressemblant à une pointe légèrement arrondie |
Cicatrice lisse, glabre, relativement épaisse au centre et à bords extérieurs étroits, ressemblant à une pointe légèrement arrondie |
Cicatrice formant une étroite crête arrondie, glabre au centre et présentant de courts poils sur les bords extérieurs |
|
Paléole |
Paléole presque transparente à travers laquelle on peut voir le caryopse; légèrement granuleuse entre les carènes |
Paléole à sommet généralement aplati; semi-translucide, à travers laquelle on peut voir le caryopse; parfois enroulée et masuqant ainsi le caryopse; présentant de courts poils épars entre les carènes |
Paléole opaque à semi‑transparente, granuleuse ou présentant des poils épars entre les carènes |
|
Poils des carènes de la paléole (dents) |
Répartis uniformément, courts et raides, larges à la base et s’effilant en une pointe; poils de longueur uniforme jusqu’au sommet de la paléole |
Répartis uniformément, courts et raides, larges à la base et s’effilant en une pointe; poils plus longs près du sommet de la paléole |
Répartis uniformément, courts et raides, larges à la base et s’effilant en une pointe |
|
Dimensions du caryopse* |
3,2 – 4,5 mm de long; 0,5 – 0,6 mm de large |
2,6 – 4,8 mm de long; 0,7 – 1,1 mm de large |
2,1 – 2,7 mm de long; 0,5 – 0,7 mm de large |
|
Hile* |
Linéaire; d’une longueur correspondant environ aux trois quarts la longueur du caryopse |
Linéaire; d’une longueur correspondant environ aux neuf dixièmes la longueur du caryopse |
Linéaire; d’une longueur correspondant à un peu plus de la moitié de la longueur du caryopse |
Click to select species
Cliquez pour sélectionner les espèces

Festuca bromoides

Festuca octoflora
Comparison Window
Fenêtre de comparaison
MAIN SPECIES
ESPÈCES PRINCIPALES
Festuca myuros

Festuca myuros
Poaceae
Festuca myuros (vulpie queue-de-rat) fleurons
MAIN SPECIES
ESPÈCES PRINCIPALES
Festuca myuros

Festuca myuros
Poaceae
Festuca myuros (rattail fescue) floret lemma margins with long ciliate hairs. [Vulpia myuros] Scale in mm
MAIN SPECIES
ESPÈCES PRINCIPALES
Festuca myuros

Festuca myuros
Poaceae
Festuca myuros (rattail fescue) close-up of florets, lemma covered with short stiff hairs (left), lemma margins without ciliate hairs (middle), and lemma margins with long ciliate hairs. [Vulpia myuros]
MAIN SPECIES
ESPÈCES PRINCIPALES
Festuca myuros

Festuca myuros
Poaceae
Festuca myuros (rattail fescue) rachilla is thin and cylindrical and covered with short stiff hairs. [Vulpia myuros]
MAIN SPECIES
ESPÈCES PRINCIPALES
Festuca myuros

Festuca myuros
Poaceae
Festuca myuros (rattail fescue) glumes and attached pedicel; in this species the lower glume is less than one-half the length of the upper glume. [Vulpia myuros] Scale in mm
MAIN SPECIES
ESPÈCES PRINCIPALES
Festuca myuros

Festuca myuros
Poaceae
Festuca myuros (rattail fescue) caryopses, embryo view (left) and hilum view (right). [Vulpia myuros] Scale in mm
SIMILAR SPECIES
ESPÈCES SEMBLABLES
Festuca bromoides

Festuca bromoides
Poaceae
Festuca bromoides (vulpie faux-brome) fleurons
SIMILAR SPECIES
ESPÈCES SEMBLABLES
Festuca bromoides

Festuca bromoides
Poaceae
Festuca bromoides (brome fescue) caryopses, embryo view (left) and hilum view (right). [Vulpia bromoides] Scale in mm
SIMILAR SPECIES
ESPÈCES SEMBLABLES
Festuca bromoides

Festuca bromoides
Poaceae
Festuca bromoides (brome fescue) rachilla is thin and cylindrical and covered with short stiff hairs. [Vulpia bromoides]
SIMILAR SPECIES
ESPÈCES SEMBLABLES
Festuca bromoides

Festuca bromoides
Poaceae
Festuca bromoides (brome fescue) close-up view of palea showing short stiff hairs (palea teeth) along the exposed palea keels transitioning into longer and more closely spaced hairs near palea tip. [Vulpia bromoides]
SIMILAR SPECIES
ESPÈCES SEMBLABLES
Festuca bromoides

Festuca bromoides
Poaceae
Festuca bromoides (brome fescue) close-up view of florets showing surface texture detail. Lemma tip and base of awn (left) covered with short stiff hairs. Palea view (right) showing short stiff hairs (palea teeth) along the palea keels transitioning into longer and more closely spaced hairs near palea tip. [Vulpia bromoides]
SIMILAR SPECIES
ESPÈCES SEMBLABLES
Festuca bromoides

Festuca bromoides
Poaceae
Festuca bromoides (brome fescue) florets, lemma view (left) and palea view (right). [Vulpia bromoides] Scale in mm
SIMILAR SPECIES
ESPÈCES SEMBLABLES
Festuca bromoides

Festuca bromoides
Poaceae
Festuca bromoides (brome fescue) glumes and attached pedicel; in this species the lower glume is one-half or more the length of the upper glume. [Vulpia bromoides] Scale in mm
Need ID Help?
Besoin d’aide pour l’identification?
Reference(s)
Référence(s)
Akhter, M. J., Jensen, P. K., Matthiassen, S. K., Melander, B. & Kudsk, P. 2020. Biology and Management of Vulpia myuros—An Emerging Weed Problem in No-Till Cropping Systems in Europe. Plants (Basel) 9(6): 715-729. https://doi.org/10.3390/plants9060715.
Aldén, B., S. Ryman, & M. Hjertson. 2012. Svensk Kulturväxtdatabas, SKUD (Swedish Cultivated and Utility Plants Database; online resource) https://skud.slu.se/nav/taxa?epslanguage=sv&p=1282 Accessed January 28, 2023.
Alderman, S. C., Elias, S. G., Hulting, A. G. 2011. Occurrence and trends of weed seed contaminants in fine fescue seed lots in Oregon. Seed Technology 33(1):7-21.
Alderson, J. & W. C. Sharp. 1995. Grass varieties in the United States, U.S.D.A. Agric. Handbook 170, rev. ed. CRC Press.
Association of Official Seed Analysts (AOSA). 2022. Rules for Testing Seeds. Volume 3: Uniform Classification of Weed and Crop Seeds. Association of Official Seed Analysts, Washington DC.
Baldwin, B. G., Goldman, D. H., Keil, D. J., Patterson, R., Rosatti, T. J., Wilken, D. H. (Eds.). 2012. The Jepson Manual: Vascular Plants of California. 2nd edition. University of California Press, Berkeley, CA.
Barkworth, M. E., Capels, K. M., Long, S., and Piep, M. B. (Eds.). 2007. Flora of North America Volume 24. Magnoliophyta: Commelinidae (in part): Poaceae, part 1. Oxford University Press, New York, New York.
Bojňanský, V. and Fargašová, A. 2007. Atlas of Seeds and Fruits of Central and East-European Flora: The Carpathian Mountains Region. Springer, Dordrecht, The Netherlands.
Büchi, L., Cordeau, S., Hull, R. & Rodenburg, J. 2020. Vulpia myuros, an increasing threat for agriculture. Weed Research 61(1): pp.13-24. https://doi.org/10.1111/wre.12456.
Centre for Agriculture and Bioscience International (CABI). 2023. Invasive Species Compendium, CAB International, Wallingford, UK. Vulpia myuros (annual fescue) – Datasheet. https://www.cabi.org/isc/datasheet/117880. Accessed January 10, 2023.
DiTomaso, J. M. and Healy, E. A. 2007. Weeds of California and Other Western States. Vol. 2: Geraniaceae – Zygophyllaceae. Agriculture and Natural Resources Publication 3488. University of California, Oakland, CA.
eFloras. 2023. Flora of China. Vulpia myuros. http://www.efloras.org/florataxon.aspx?flora_id=2&taxon_id=220014224 Accessed January 10, 2023.
Garry Oak Ecosystems Recovery Team (GOERT), (n.d.). Vulpia bromoides & myuros. Invasive Species in Garry Oak and Associated Ecosystems in British Columbia. Garry Oak Ecosystems Recovery Team. https://goert.ca/wp/wp-content/uploads/IS-factsheet-vulpia-bromoides-myuros.pdf. Accessed January 20, 2023.
International Seed Morphology Association (ISMA). 2020. Method for seed size measurement. Version 1.0. ISMA Publication Guide.
Lyon, D. J., Ball, D. A. & Hulting, A. G. 2018. Rattail Fescue: Biology and Management. In: Pacific Northwest Wheat Cropping Systems. A Pacific Northwest Extension Publication. PNW613. https://pubs.extension.wsu.edu/rattail-fescue-biology-and-management-in-pacific-northwest-wheat-cropping-systems.
Martin, A. C. 1946. The comparative internal morphology of seeds. The American Midland Naturalist 36(3):513-660.
Sharp, D. and Simon, B.K. 2002. AusGrass: Grasses of Australia. CD-ROM, Version 1.0 (Australian Biological Resources Study, Canberra, and Environmental Protection Agency, Queensland). https://keys.lucidcentral.org/keys/v3/AusGrass/key/AusGrass/Media/Html/VULPIA/VULMYU.HTML Accessed January 17, 2023.
Terrell, E. E. 1971. Survey of occurrences of liquid or soft endosperm in grass genera. Bull. Torr. Botan. Club 98(5):264-268.
Tutin, T. G., Haywood, V. H., Burges, N. A., Moore, D. M., Valentine, D. H., Waters, S. M., Webb, D. A. (Eds.). 1980. Flora Europaea. Volume 5: Alismataceae to Orchidaceae (Monocotyledons). Cambridge University Press.
United States Department of Agriculture-Agricultural Research Services (USDA-ARS). 2023. Germplasm Resources Information Network (GRIN). http://npgsweb.ars-grin.gov/gringlobal/taxon/taxonomydetail?id=16682. Accessed January 10, 2023.
United States Department of Agriculture-Natural Resources Conservation Service (USDA-NRCS). 2023. The PLANTS Database. National Plant Data Team, Greensboro, NC USA. http://plants.usda.gov Accessed January 10, 2023.
Weber, E. 2017. Vulpia myuros (L.) C.C. Gmel. in E. Weber (Auth.) Invasive Plant Species of the World 2nd Edition. A Reference Guide to Environmental Weeds. Wallingford, Oxfordshire; Boston, MA: CABI, 2016: pp. 495. https://cabidigitallibrary.org/doi/epdf/10.1079/9781780643861.0000.
Wiersema, J. H. and León, B. 1999. World Economic Plants: A Standard Reference. CRC Press, Boca Raton, FL.